Verbesserte Osseointegration und Bio-Dekontamination von nanostrukturiertem Titan
Basierend auf nicht-thermischem Atmosphärendruck-Plasma
von Yuhao Zeng 1,*, Satoshi Komasa 1 [OrcID] , Hisataka Nishida 2, Akinori Agariguchi 1, Tohru Sekino 2 [OrcID] und Joji Okazaki 1
Int. J. Mol. Sci. 2020, 21(10), 3533; https://www.mdpi.com/1422-0067/21/10/3533
Abstract
Eine alkalibehandelte Titanatschicht mit Nanonetzwerkstrukturen (TNS) ist eine vielversprechende Oberfläche zur Verbesserung der Osseointegrationsfähigkeit bei Implantaten. Dennoch besteht das Risiko eines Geräteversagens aufgrund einer unzureichenden Beständigkeit gegen Biofilmkontamination. In dieser Studie wurde geprüft, ob die Behandlung mit einem tragbaren, nichtthermischen Plasmagerät die Biofilmkontamination effizient beseitigen kann, ohne die Oberflächen-Nanostruktur zu zerstören, und gleichzeitig eine Oberfläche wiederherstellen kann, die die Knochenneubildung fördert. TNS-Proben wurden mit einem piezoelektrischen Direktentladungs-Plasmagenerator (PDD) behandelt. Der Dekontaminationseffekt wurde unter Verwendung von Staphylococcus aureus durchgeführt. Die Bewertung der anfänglichen Zellanhaftung mit Adhäsionsbildern, der Aktivität der alkalischen Phosphatase, der Mineralisierung der extrazellulären Matrix und der Expression von Genen, die mit der Osteogenese in Zusammenhang stehen, wurde mit mesenchymalen Stammzellen aus dem Rattenknochenmark durchgeführt, und die Knochenreaktion wurde in vivo mit einem Rattenfemurmodell bewertet. Nanotopographie und Oberflächenrauhigkeit unterschieden sich vor und nach den Plasmabehandlungen nicht signifikant. Die Zell- und Knochenbildungsaktivität wurde durch die TNS-Plasmabehandlung verbessert. Darüber hinaus wurde durch die Plasmabehandlung die Biofilmkontamination der Oberfläche wirksam beseitigt. Diese Ergebnisse legen nahe, dass diese Plasmabehandlung ein vielversprechender Ansatz für die Behandlung von Nanomaterialien unmittelbar vor der Implantation und eine therapeutische Strategie für Periimplantitis sein könnte.
1. Einleitung
Titan ist aufgrund seiner hervorragenden mechanischen Eigenschaften, Korrosionsbeständigkeit und Biokompatibilität eines der am häufigsten verwendeten Materialien für orthopädische und dentale Implantate [1,2]. Dennoch ist die Verwendung von Titanimplantaten durch das Risiko von periimplantären Infektionen, eine verlängerte Einheilzeit der Osseointegration und unzureichende osteokonduktive Eigenschaften, insbesondere bei Patienten mit Osteoporose, begrenzt [3]. Die klinischen Langzeiterfolgsraten von Implantaten auf Titanbasis liegen bei 89,23% und 82,94% nach 10- bzw. 16-jähriger Nachbeobachtungszeit [4]. Um die klinische Langzeiterfolgsrate von Implantaten weiter zu erhöhen, sind die Förderung der frühen Osseointegration, die langfristige Stabilität der Knochen-Implantat-Grenzfläche und eine reduzierte Periimplantitis erforderlich [2,5,6]. Die physikalischen und chemischen Eigenschaften der Implantatoberfläche spielen eine entscheidende Rolle bei der frühen Knochenbildung um Implantate herum [7].
Aufgrund der Anfälligkeit der passiven Oxidschicht und ihrer elektrischen Leitfähigkeit wurden in den letzten drei Jahrzehnten Implantatoberflächenmodifikationen wie Sandstrahlen [8], Säureätzen [9], Oxidation [10] und Kalziumphosphatabscheidung (allein oder in Kombination) [11,12] vorgenommen, um die Rauheit, die mikro- und nanoskaligen Eigenschaften und die chemische Zusammensetzung der Implantatoberfläche zu verändern; diese Modifikationen können eine hohe Biokompatibilität verleihen und eine frühe Knochenbildung um die Implantate herum fördern [13,14,15].
Unsere bisherigen Untersuchungen zeigen, dass nach hochkonzentrierter alkalischer Behandlung auf der Titanoberfläche eine homogene, hydrophile Natriumtitanatschicht mit Nanonetzwerkstrukturen (TNS) entsteht [16]. TNS weist im Vergleich zu Ti eine höhere Rauhigkeit und Hydrophilie auf und ist daher besser mit der Protein- und Zellanhaftung sowie der Hydroxylapatitbildung kompatibel; diese Faktoren führen zu einer ausgezeichneten osteogenen Aktivität [17]. Dennoch müssen vor ihrer klinischen Anwendung noch einige Herausforderungen gelöst werden. Genauer gesagt ist alkalibehandeltes Titan mit Nanostrukturen immer noch unzureichend in Bezug auf die Resistenz gegen die bakterielle Anheftung und die Bildung von Biofilmen, die letztendlich Periimplantitis verursachen können [18], und schneller ist die Osseointegration in der frühen Phase der Implantation immer noch eine Voraussetzung.
Plasma ist einer der vier Grundzustände der Materie und wird definiert als ein neutrales ionisiertes Gas, das aus Teilchen in ständiger Wechselwirkung besteht, zu denen Photonen, Elektronen, positive und negative Ionen, Atome, freie Radikale und angeregte oder nicht angeregte Moleküle gehören. Plasma konnte bei Atmosphärendruck durch verschiedene Techniken wie Hochfrequenz (HF)-Plasmen [19], Plasmen mit dielektrischer Barriere (DBD)-Entladungen [20], Koronaentladungsplasmen [21], Gleitbogenentladungsplasmen [22,23] erhalten werden. Als Folge der Produktion reaktiver Sauerstoff- und Stickstoffspezies (RONS) wurde die Plasmabehandlung eingesetzt, um Verunreinigungen zu entfernen und den Implantatoberflächen Hydrophilie zu verleihen, was wiederum die Protein- und Zelladhäsion fördert [24,25]. Nach Lee et al. vermindert die Plasmabehandlung die bakterielle Anhaftung durch Kohlenstoffreinigung der Implantatoberfläche, wodurch das Risiko einer Implantatinfektion verringert wird [26]. Die durch die Plasmabehandlung erzeugten RONS könnten die Biofilm-Rekolonisierung auf der Implantatoberfläche dekontaminieren und hemmen, ohne die ausgeklügelte Oberflächengeometrie des Implantats zu zerstören, und gleichzeitig die Osteoblastenanhaftung und -differenzierung fördern [23,25,27,28]. Die Plasmabehandlung ist ungiftig, bei niedrigen Temperaturen, sicher und hat eine hohe Behandlungseffizienz, so dass sie für klinische Anwendungen besser geeignet ist als andere Sterilisationsmethoden. Die Verwendung eines tragbaren, nichtthermischen, atmosphärischen Plasmageräts, das piezoelektrische Technologie verwendet, hat sich in letzter Zeit auf medizinische Anwendungen konzentriert. Da es eine höhere Verarbeitungseffizienz hat und umweltfreundlicher als UV-, Laser- und andere Arten der Plasmabehandlung ist, eignet sich das nichtthermische, atmosphärische Plasmagerät sehr gut für die unmittelbare Behandlung vor der Implantation. Gleichzeitig ist dieses nichtthermische atmosphärische Plasma, das Biofilm eliminieren und gleichzeitig Oberflächeneigenschaften wiederherstellen könnte, die für die Knochenregeneration förderlich sind, besonders für die Behandlung von Periimplantitis geeignet [29].
In der vorliegenden Studie stellten wir die Hypothese auf, dass eine nichtthermische atmosphärische Plasmabehandlung die chemischen Komponenten auf der Implantatoberfläche verändern und die durch die Alkalibehandlung entstandene Rauheit der nanostrukturierten Oberfläche erhalten und dadurch die Osseointegration und Dekontamination fördern könnte. Um diese Hypothese zu beweisen, untersuchten wir die Wirkung der Plasmabehandlung auf die Biofilmbildung, Zelladhäsion und Osseointegration in der frühen Phase der Implantation durch in-vivo- und in-vitro-Experimente. Staphylococcus aureus wurde verwendet, um die Wirkung der Plasmabehandlung auf die Dekontamination zu veranschaulichen. Die Plasmabehandlung des TNS veränderte wirksam die chemische Zusammensetzung auf der Probenoberfläche, was die Hydrophilie des Implantats weiter verbesserte und die Zellanhaftung und osteogene Differenzierung erleichterte, während der Biofilm dekontaminiert wurde, ohne die Nanomorphologie der TNS-Oberfläche zu zerstören. Die Plasmabehandlung hat potenzielle klinische Anwendungen, wie die unmittelbare Behandlung vor der Implantation und die therapeutische Behandlung von Periimplantitis.
2. Ergebnise
2.1. Oberflächen Charakterisierung
Die Rasterelektronenmikroskopie (REM), die einen bedeutenden Beitrag zur Beobachtung und Charakterisierung der Nanomorphologie geleistet hat, wurde zur Untersuchung der Oberflächentopographie von TNS- und Plasma-TNS-Proben eingesetzt. REM-Aufnahmen zeigten, dass die nanoporöse Netzwerkstruktur innerhalb eines durchschnittlichen Durchmessers von 50-100 nm auf nanostrukturiertem Titan nach der Alkalibehandlung gut miteinander verbunden und homogen war. Wie in Abbildung 1 dargestellt, veränderte sich die nanoporöse Struktur der Probenoberfläche nach der Plasmabehandlung nicht signifikant. Die durch Rasterkraftmikroskopie (AFM) gemessene Wirkung der Plasmabehandlung auf die Oberfläche zeigte ähnliche Nanotopographien auf den Oberflächen von TNS- und Plasma-TNS-Proben (Abbildung 1). Darüber hinaus zeigten die mittels AFM gemessenen Werte der Oberflächenrauheit (Ra und Rz), dass es keinen signifikanten Unterschied zwischen TNS- und Plasma-TNS-Proben gab (Tabelle 1). Die Hydrophilie-Analyse der Oberfläche von TNS- und Plasma-TNS-Proben zeigte, dass die TNS-Oberfläche hydrophile Eigenschaften mit einem Kontaktwinkel von etwa 9° aufwies. Insbesondere wurde eine signifikante Veränderung der Benetzbarkeit auf der Oberfläche von Plasma-TNS-Proben mit einem Kontaktwinkel von <3° erkannt, die superhydrophile Eigenschaften aufwiesen (Abbildung 1E).
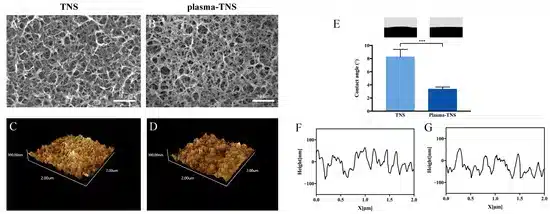
| Gruppe | Parameter Ra (nm) | Parameter Rz (nm) |
|---|---|---|
| TNS | 24.71 ± 7.14 | 218.93 ± 89.48 |
| Plasma-TNS | 27.16 ± 5.01 | 233.90 ± 19.79 |
Tabelle 1. Rauheitswerte des TNS und Plasma-TNS. Die gezeigten Daten sind die Mittelwerte ±SD (n = 3).
Die chemische Zusammensetzung und die chemische Bindung auf TNS- und Plasma-TNS-Oberflächen wurden mittels Röntgen-Photoelektronenspektroskopie (XPS) untersucht. Die XPS-Spektren der Proben zeigten, dass die chemische Zusammensetzung der Oberfläche die charakteristischen Peaks von Ti, O, C, N und Na enthielt. Um die Veränderungen der chemischen Zusammensetzung und der chemischen Bindung nach der Plasmabehandlung weiter zu untersuchen, wurden Spektren mit hoher Energieauflösung für C1s, O1s, N1s und Ti2p erhalten. Ti 2p3/2- und Ti 2p1/2-Komponenten wurden bei 458,5 eV bzw. 464,2 eV mit einem Spin-Orbitalspaltungswert von 5,7 eV gezeigt, der mit dem Ti4+-Valenzzustand übereinstimmt. Die Na1s-Spektren von TNS- und Plasma-TNS-Proben unterschieden sich nicht signifikant, was darauf hinweist, dass beide Probentypen mit Titanit bedeckt waren. Dies stimmte mit den Ergebnissen früherer Studien überein [30]. Das Vorhandensein einer Kohlenstoffkontamination auf allen Oberflächen war offensichtlich, was auch mit früheren Studien übereinstimmte [31]. Bemerkenswert ist, dass das Kohlenstoffverhältnis auf der Probenoberfläche nach der Plasmabehandlung signifikant abnahm. Abbildung 2 zeigt das Verhältnis von N/Ti zu O/Ti auf der Oberfläche von TNS- und Plasma-TNS-Proben. Die Verhältnisse zeigten den bemerkenswerten Anstieg des O- und N-Gehalts auf der Oberfläche von plasmabehandelten Proben.
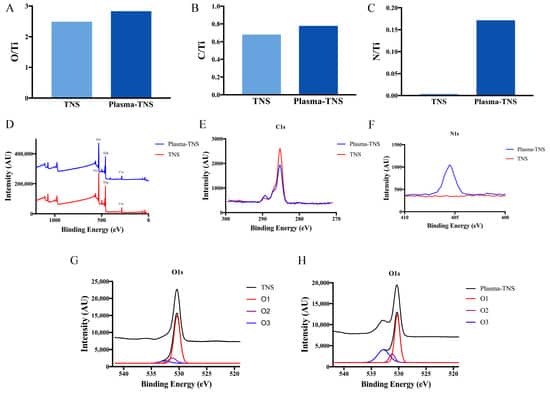
Die Spektren mit hoher Energieauflösung des N1s-Peaks vor und nach der Plasmabehandlung sind in Abbildung 2F dargestellt. Die an plasmabehandelten Proben beobachteten unterschiedlichen Spektren wurden bei einer Bindungsenergie von 406,8 eV gezeigt, was NOx (Nitrat)-Spezies entspricht [32,33]. Im Gegensatz dazu wurden nur wenige dieser Spektren auf der Oberfläche von unbehandelten Proben gefunden. Abbildung 2 zeigt auch die hochauflösenden Sauerstoff-1s-Spektren von der Oberfläche von TNS- und Plasma-TNS-Proben. Nach Moulder et al. [32] zeigt die Entfaltung des O1s-Peaks drei verschiedene Zustände der Sauerstoffatome. Die Komponente bei der Bindungsenergie von 530,3 eV (O1) entspricht dem Sauerstoff O2- in der TiO2-Gitterstruktur; die Komponente bei 531,4 eV (O2) ist oft mit -OH-Gruppen verwandt; die Komponente bei 532,7 eV (O3) ist typischerweise mit NOx- oder H2O-Gruppen assoziiert [34].
XPS-Spektren der TNS-Oberfläche zeigten, dass der meiste Sauerstoff in Form eines Oxids (O1) gebunden war, und der Anteil der -OH-Bindungen war geringer (Abbildung 2G). Dies deutet allgemein darauf hin, dass Sauerstoffatome mit größerer Wahrscheinlichkeit TiO2 auf der Probenoberfläche bilden. Im Gegensatz zur TNS-Oberfläche wurde auf der Oberfläche von Plasma-TNS-Proben eine große Anzahl von O2-Komponenten beobachtet. Diese standen mit der -OH-Gruppe in Zusammenhang und wurden durch die Wechselwirkung von energetisch reaktiven Sauerstoffspezies zwischen dem Plasma und der Materialoberfläche verursacht. Infolgedessen wurde die Hydrophilie der Materialoberfläche signifikant verbessert, was mit den Kontaktwinkel-Messergebnissen übereinstimmt. Die wichtige O3-Komponente, die typischerweise mit NOx-Gruppen assoziiert ist, wurde auf der Oberfläche von Plasma-TNS-Proben nachgewiesen; dies war darauf zurückzuführen, dass die reaktiven Stickstoffspezies (RNS) die Gasphasenchemie während der Plasmabehandlung dominierten [35,36].
2.2. Biofilm Dekontaminierung
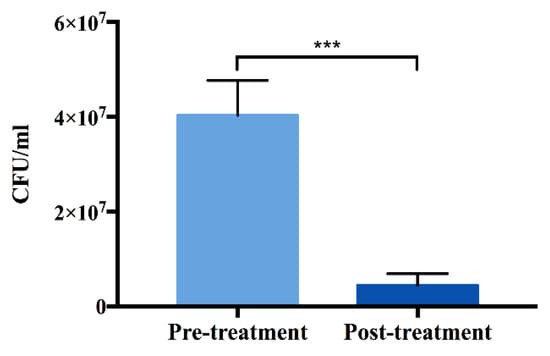
Um die Effizienz der Bio-Dekontamination durch Plasmabehandlung zu beurteilen, wurde eine Staphylococcus aureus (S. aureus)-Kultur auf der Oberfläche des TNS 24 h lang inkubiert und zu einem Biofilm entwickelt. Die Oberflächen wurden dann einer Plasmabehandlung ausgesetzt. Die Ergebnisse der Inaktivierung zeigen, dass die Plasmabehandlung die Lebensfähigkeit von S. aureus signifikant verringern konnte (Abbildung 3).
2.3. Bestimmung intrazellulärer reaktiver Sauerstoffspezies (ROS)
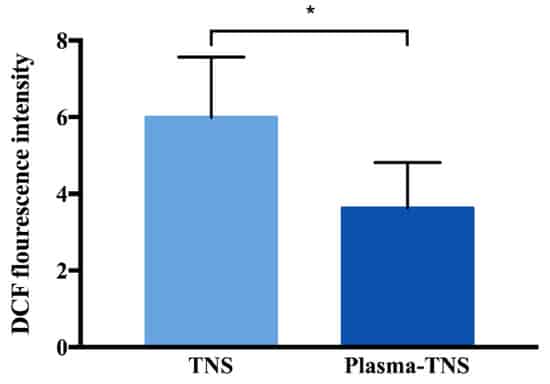
Darüber hinaus war, wie in Abbildung 4 gezeigt, die Höhe der intrazellulären ROS auf der TNS-Oberfläche nach 24-stündiger Inkubation signifikant höher als die auf der Oberfläche von Plasma-TNS-Proben, während es keinen signifikanten Unterschied in der Anzahl der anhaftenden Zellen zwischen beiden Oberflächentypen gab.
2.4. Zelladhäsion und Morphologie
Nach 24-stündiger Inkubation zeigte die Zellmorphologiefärbung mit Phalloidin und DAPI, dass die an plasmabehandelten Oberflächen anhaftenden Zellen eine höhere Zellfläche hatten als die an unbehandelten Oberflächen anhaftenden Zellen (Abbildung 5A-E). Die Zunahme der anfänglichen Zelladhäsion und die Veränderungen der Zellmorphologie trugen wahrscheinlich zu der durch die Plasmabehandlung erzeugten Superhydrophilie der Oberfläche bei [37] in Übereinstimmung mit den Ergebnissen der Hydrophilieanalyse bei. Darüber hinaus wurde der CellTiter-Blue® Cell Viability Assay verwendet, um die Adhäsion von mesenchymalen Stammzellen aus dem Knochenmark der Ratte (rBMMSCs) an TNS- und Plasma-TNS-Proben zu bewerten. Die Ergebnisse zeigten eine höhere Anzahl von Zellen, die nach 1, 3 und 6 Stunden an der Oberfläche von Plasma-TNS-Proben anhafteten (Abbildung 5F).
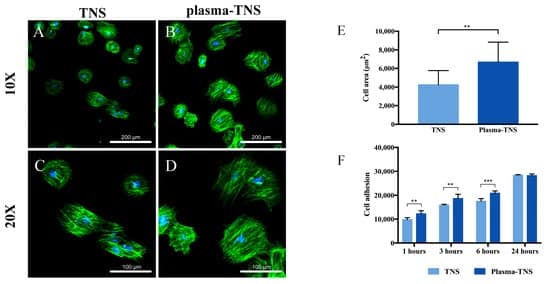
2.5. Osteogene Aktivität von mesenchymalen Stammzellen aus dem Knochenmark der Ratte (rBMMSCs)
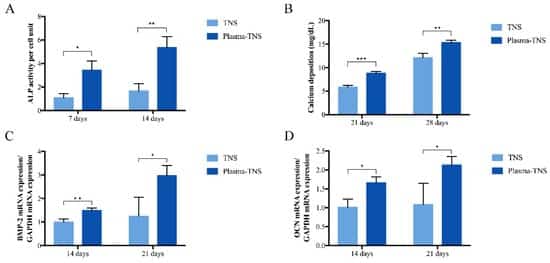
Die ALP-Aktivität, die ein biochemischer Marker der Osteoblastenaktivität und des Zellphänotyps im frühen Stadium der Zelldifferenzierung und Knochenbildung ist, war nach sieben und 14 Tagen in der Plasma-TNS-Gruppe höher als in der TNS-Gruppe (Abbildung 6A). Im Vergleich zur TNS-Gruppe zeigte die Plasma-TNS-Gruppe nach 21 und 28 Tagen eine höhere Kalziumablagerung (ein Marker der Mineralisierung der extrazellulären Matrix) (Abbildung 6B). Die Genexpression des knochenmorphogenetischen Proteins (BMP) und von Osteocalcin (OCN), die repräsentative osteogene Differenzierungsprodukte sind, war in Zellen, die auf Plasma-TNS kultiviert wurden, signifikant höher als in Zellen, die auf TNS-Proben kultiviert wurden (Abbildung 6C,D). Diese Ergebnisse zeigten, dass die Differenzierungsaktivität von rBMMSCs durch mit Plasma behandelte Oberflächen signifikant gefördert wurde.
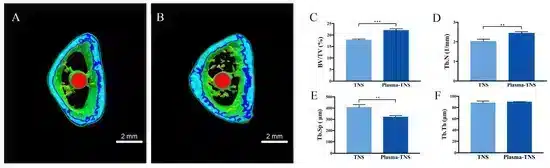
2.6. Bewertung der Knochenmorphogenese um das Implantat herum In Vivo
Die Knochenbildungsaktivität um das TNS-Implantat und das Plasma-TNS-Implantat wurde mit Hilfe eines Rattenfemurmodells evaluiert. Es wurde mehr trabekuläre Mikroarchitektur im Bereich der Plasma-TNS-Oberfläche als im Bereich der TNS-Oberfläche beobachtet (Abbildung 7). Darüber hinaus waren das Verhältnis von Knochenvolumen zum Gesamtvolumen (BV/TV), die mittlere Trabekelzahl (Tb.N) und die mittlere Trabekeldicke (Tb.Th) in den Plasma-TNS-Proben signifikant höher, was darauf hinweist, dass die plasmabehandelten Implantate die Osteogeneseaktivität förderten (p < 0,01). Die mittlere Trabekelseparation (Tb.Sp) war im Plasma-TNS-Implantat geringer als im TNS-Implantat (p < 0,01).
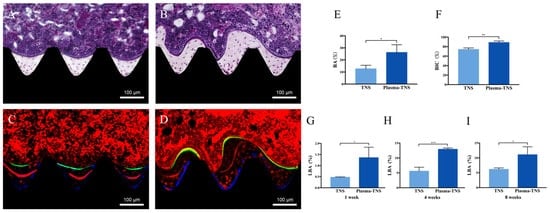
Darüber hinaus wurde ein Längsschnitt verwendet, um die Knochenneubildung um das Implantat herum zu beurteilen. Wie in Abbildung 8 dargestellt, wurde um das Plasma-TNS-Implantat herum mehr Knochenneubildung beobachtet als um das TNS-Implantat. Quantitativ zeigte die histomorphometrische Analyse, dass das Knochenflächenverhältnis (BA) und der Knochen-Implantat-Kontakt (BIC) um die Plasma-TNS-Implantate herum signifikant höher waren als um die TNS-Implantate (Abbildung 8E,F). Darüber hinaus wurde der neu gebildete Knochen um das Implantat herum nach einer Woche mit Oxytetracyclinhydrochlorid (blau), nach vier Wochen mit Alizarinrot S (rot) und nach acht Wochen mit Calcein (grün) markiert. Der markierte Knochenbereich zwischen dem Implantat-Interface und dem markierten Knochenbereich war in den Wochen 1, 4 und 8 bei Plasma-TNS-Implantaten signifikant höher als bei TNS-Implantaten (Abbildung 8G-I).
3. Diskussion
Die Oberflächenmorphologie und die chemische Zusammensetzung auf der Oberfläche mit Nanostrukturen aus Titan spielen eine entscheidende Rolle bei der Nachahmung von natürlichem Knochengewebe und Weichgeweben, um den Knochenheilungsprozess zu fördern, was in der Literatur ausführlich beschrieben wurde [15]. Unseren früheren Experimenten zufolge verbesserten die homogenen nanoporösen Strukturen auf der Titanoberfläche, die durch die Alkalibehandlung erzeugt wurden, die Osseointegration und trugen zu ihrer hervorragenden Hydrophilie und Rauheit im Vergleich zu Reintitan bei [16,17]. Dennoch ist die Beständigkeit der nanostrukturierten Oberflächen gegenüber Biofilm noch immer unzureichend, was zu Periimplantitis und, noch schneller, zur Osseointegration führen könnte, die in der frühen Phase der Implantation nach wie vor erforderlich ist. In der vorliegenden Studie wurde nicht-thermisches Atmosphärendruckplasma zur Modifizierung der nanostrukturierten Oberfläche eingesetzt, und die Wirkung der Förderung der osteogenen Aktivität und der Dekontamination wurde umfassend evaluiert.
Gemäß den von REM und AFM beobachteten Nanotopographien zeigten die Probenoberflächen eine ähnliche homogene nanoporöse Netzwerkstruktur, unabhängig davon, ob sie mit Plasma behandelt wurden oder nicht, was darauf hindeutet, dass die Plasmabehandlung die Geometrie der Nanostruktur auf der Probenoberfläche nicht zerstört und dadurch der positive Effekt der Nanostruktur auf die Osseointegration erhalten bleiben könnte. Zusätzlich bestätigte die XPS-Analyse, dass sich die chemische Zusammensetzung auf der Probenoberfläche nach der Plasmabehandlung signifikant verändert hat. Im Vergleich zur Oberfläche des TNS bildet sich nach der Plasmabehandlung eine große Anzahl polarer Sauerstoffgruppen (wie Hydroxyl-, Carbonyl- und Carboxylgruppen), was deren Hydrophilie verstärken könnte [35]. Dies stimmt mit der Analyse des Kontaktwinkel-Experiments überein, die feststellt, dass die Hydrophilie der Plasma-TNS-Oberfläche weiter verbessert wurde. Gleichzeitig wurde die Zunahme von NOx nach der Plasmabehandlung auch durch die XPS-Analyse nachgewiesen und könnte auf das durch das Plasma erzeugte übermäßige Gasphasen-RNS zurückzuführen sein [38].
Darüber hinaus wurden die Abnahme des Kohlenstoffs und die Bildung von RONS nach der Plasmabehandlung beobachtet und als mit der Wirksamkeit der Dekontamination und der Hemmung der frühen Bakterienanheftung und Biofilmbildung verbunden angesehen [39,40,41,42]. Während der Plasmadekontamination werden Bakterien direkt der Plasmafahne ausgesetzt, die aus reichlich RONS besteht, die Membranveränderungen und Enzymhemmung induzieren, Veränderungen in den Membrantransportproteinen hervorrufen, was zur Anhäufung von mehr RONS führt, was schließlich zu physiologischer Dysfunktion und Zelltod führt [43,44]. Darüber hinaus zeigten die Ergebnisse des Dekontaminationsexperiments, dass die auf die mit Biofilm kontaminierte nanostrukturierte Oberfläche angewandte Plasmabehandlung den Biofilm wirksam beseitigen konnte, ohne die Nanostruktur der Oberfläche zu zerstören. Darüber hinaus zeigten Lee et al., dass die Plasmabehandlung die Kohlenstoffkontamination zur Bildung einer hydrophilen Oberfläche verringern kann, wodurch die Resistenz gegen bakterielle Anheftung verbessert und die Rekolonisation von Biofilmen gehemmt wird, was aus klinischer Sicht sehr vorteilhaft wäre [26].
Nach den Ergebnissen des Zelladhäsionsexperiments induzierte die Plasmabehandlung keine Zellapoptose und förderte sogar die Zellanheftung in der frühen Inkubationsphase [45]. Die Analyse der Zellmorphologie ergab höhere Zellbereiche auf den Oberflächen, die der Plasmabehandlung unterzogen wurden, was wahrscheinlich zu einem erhöhten hydrophilen Charakter der plasmabehandelten Proben beiträgt [46]. Darüber hinaus wurde die Verbesserung der osteogenen Differenzierungsfähigkeit der Zellen durch die Ergebnisse der ALP-Aktivität, der Kalziumablagerung und der Expression des knochenmorphogenetischen Proteins 2 und des Osteocalcin-Gens nachgewiesen. Gleichzeitig konnte in Tierversuchen auch gezeigt werden, dass die Plasmabehandlung umfassend zur Förderung der Knochenneubildung und Osseointegration beiträgt. Gemäß Mikro-CT, histologischem Schnitt und Fluoreszenzmarkierungsanalysen hatte die Plasmabehandlung einen signifikanten positiven Effekt auf die Förderung der Osteogenese. Insbesondere wurden durch die Plasmabehandlung Oberflächen erzeugt, die die Bildung neuen Knochengewebes in den Wochen 1 und 4 nach der Implantation stark förderten, zur Osteogenese beitrugen und die Implantatstabilität bestätigten. Diese Eigenschaften spielen eine entscheidende Rolle für den Implantationserfolg in der frühen Phase der Implantation, und unsere Ergebnisse unterstützen somit zukünftige Forschungswege, die diese vielversprechenden Eigenschaften nutzen und ausnutzen.
Die Ergebnisse der XPS-Analyse zeigten, dass die Plasmabehandlung die chemische Zusammensetzung auf der Oberfläche signifikant veränderte und zu einer Zunahme der polaren Sauerstoffgruppen (wie Hydroxyl-, Carboxylgruppen usw.) führte. Darüber hinaus ziehen wir es vor, die Einflüsse dieser erhöhten funktionellen Sauerstoffgruppen auf die an der plasmabehandelten Oberfläche anhaftenden Zellen zu untersuchen. Die stammzellbiologische Forschung der letzten Jahrzehnte hat sich darauf konzentriert, dass eine exzessive intrazelluläre ROS-Akkumulation Proteine, Lipide und DNA schädigen und schließlich zur Zellapoptose führen könnte [47,48]. Gleichzeitig haben wir eine Reihe von Antioxidations- und Anti-Stress-Mechanismen von Stammzellen aufgeklärt [49,50]. Nichtsdestotrotz mehren sich die Hinweise darauf, dass die intrazelluläre ROS in der Redox-Homöostase unter bestimmten Umständen eine entscheidende Rolle bei der Aufrechterhaltung der Selbsterneuerung von Stammzellen spielt [51]. In der Tat befinden sich Stammzellen in einem Zustand, der durch niedrige Werte intrazellulärer ROS gekennzeichnet ist, die für die Regulierung des Potenzials zur Selbsterneuerung und Stammlosigkeit von entscheidender Bedeutung sind, während hohe Werte intrazellulärer ROS die Fähigkeit von Stammzellen zur Selbsterneuerung und Differenzierung wirksam hemmen [52,53,54]. Nach Ueno et al. berichteten Ueno et al. außerdem, dass eine mit UV-Licht vorbehandelte Titanoberfläche die intrazelluläre ROS und die Expression entzündlicher Zytokine signifikant reduziert, so dass die durch oxidativen Stress induzierte DNA-Schädigung verhindert und die Zelladhäsion und -verbreitung gefördert wird [55]. Folglich kann die Untersuchung des Zusammenhangs zwischen intrazellulären ROS-Spiegeln und veränderten chemischen Eigenschaften nach der Plasmabehandlung Einblicke in den Mechanismus geben, durch den die Plasmabehandlung die Osseointegration in der frühen Phase der Implantation fördert. Wie die Ergebnisse gezeigt haben, zeigen Zellen, die an der plasmabehandelten Oberfläche angeheftet sind, im Vergleich zu denen auf der unbehandelten Oberfläche einen niedrigeren Spiegel intrazellulärer ROS, während die osteogene Aktivität zunimmt. Kürzlich haben Gómez-Puerto et al. gezeigt, dass funktionelle Sauerstoffgruppen die Phosphorylierung der Forkhead-Box O3 (FOXO3) bei Serin 294, die durch die MAPK8-Kinase vermittelt wurde, und deren Translokation in den Zellkern induzieren konnten. Gleichzeitig führt die Aktivierung von FOXO3 zur Herunterregulierung der intrazellulären ROS durch die Aktivierung der Autophagie zur Aufrechterhaltung der Redox-Homöostase während der osteoblastischen Differenzierung [56]. Darüber hinaus könnte die Überexpression des FOXO3-Gens in den Osteoblasten den oxidativen Stress und die Apoptose der Osteoblasten verringern und die Knochenbildungsrate erhöhen [57]. Wir stellten die Hypothese auf, dass die funktionellen Sauerstoffgruppen auf der plasmabehandelten Oberfläche die Phosphorylierung von FOXO3 aktivieren könnten, um den oxidativen Stresszustand herunterzuregulieren, was einer der möglichen Mechanismen der erhöhten osteogenen Aktivität nach der Plasmabehandlung zu sein scheint. In Zukunft sollen weitere Experimente durchgeführt werden, um zu bestätigen, ob die in der Plasma-TNS-Gruppe beobachtete bessere osteogene Aktivität auf die Abnahme der intrazellulären ROS zurückzuführen ist, die durch sauerstoffunktionelle Gruppen induziert wird, welche die Phosphorylierung von FOXO3 vermitteln.
Zusammenfassend konnte gezeigt werden, dass die Plasmabehandlung einen bemerkenswerten Beitrag zur Steigerung der osteogenen Aktivität und zur Dekontamination der Oberfläche leisten kann. Durch die Bewertung der Oberflächeneigenschaften und der Biofilm-Dekontamination bestätigten wir, dass die Plasmabehandlung die Kontamination beseitigen kann, ohne die vorteilhafte Nanostruktur der Oberfläche zu zerstören. Im Anschluss an die Ergebnisse des Experiments zur osteogenen Aktivität sowohl in vitro als auch in vivo verifizierten wir auch, dass die Oberfläche nach der Plasmabehandlung sehr vorteilhaft für die Verbesserung der osteoblastären Differenzierung und der frühen osteogenen Aktivität ist. Aufgrund der hervorragenden Wirkung der gleichzeitigen Wiederherstellung einer hoch hydrophilen Oberfläche, die für die Osseointegration und die Eliminierung des Biofilms geeignet ist, und aufgrund der klinisch günstigen Vorteile der Plasmabehandlung, wie z.B. handgehaltener, reibungsloser Betrieb, niedrige Kosten, wird erwartet, dass die weit verbreitete Anwendung von Plasma entweder als Behandlung unmittelbar vor der Implantation oder als therapeutische Strategie bei Periimplantitis vorteilhaft sein wird. Darüber hinaus zeigte diese Studie, dass die Rauheit der nanostrukturierten Oberfläche durch die Plasmabehandlung nicht verändert wird, was für die kombinierte Anwendung dieser Plasmabehandlung und anderer Materialien mit der Nanostruktur von großer Bedeutung sein könnte. In zukünftigen Experimenten werden wir auch ein Infektionstiermodell etablieren und die Effizienz der Plasmabehandlung an infizierten Implantaten als neuartige therapeutische Strategie bei Periimplantitis umfassend evaluieren.
4. Materialien und Methoden
4.1. Probenvorbereitung
Scheiben aus Reintitan Grad 2 (15 mm Durchmesser und 1 mm Dicke) und Schraubenimplantate aus Titan (1,2 mm Außendurchmesser und 12 mm Länge) wurden durch mechanische Bearbeitung (Daido Steel, Osaka, Japan) zur Bewertung der Oberflächeneigenschaften bzw. für die Tierstudie vorbereitet. Die Scheiben wurden dann mit inkrementellen SiC-Schleifpapieren (800#, 1000# und 1500#) poliert. Alle Proben wurden mit Ultraschall mit Aceton, Ethanol und deionisiertem Wasser (jeweils 10 min) gespült und über Nacht bei Raumtemperatur getrocknet. Alle Proben wurden 24 Stunden lang in eine 10 M NaOH-Lösung bei 30 °C eingetaucht, mehrmals mit ionenausgetauschtem Wasser (200 mL) gewaschen, bis die Leitfähigkeit der Lösung 5 μS/cm3 erreichte, und dann über Nacht bei Raumtemperatur getrocknet, um poröse, homogene und gleichmäßige Nanonetzwerkstrukturen (TNS) auf der Titanoberfläche herzustellen.
4.2. TNS Plasmabehandlung
Die Plasmabehandlung wurde mit einem tragbaren Plasmagerät ohne thermischen Atmosphärendruck (piezobrush® PZ2, relyon plasma GmbH, Regensburg, Deutschland) durchgeführt, das die piezoelektrische Direktentladungstechnologie verwendete. Die Hälfte der Proben wurde bei Raumtemperatur 30 s lang mit Plasma behandelt, das durch aktives Gas bei Atmosphärendruck induziert wurde. Der Abstand zwischen dem Düsenaustritt und den Proben wurde auf 5 mm eingestellt, um sicherzustellen, dass die Proben vollständig in die aus der Düse austretende Plasmafahne eingetaucht waren. Plasmabehandeltes TNS wurde in der Versuchsgruppe getestet, während die Kontrollgruppe unbehandelt war.
4.3. Oberflächen Charakterisierung
TNS and plasma-TNS surface topography were evaluated by SEM (S-4800, Shimadzu, Kyoto, Japan) with 10 kV accelerating voltage. AFM (SPM-9600, Shimadzu Co., Tokyo, Japan) was utilized to assay the mean average surface roughness (Ra), mean peak-to-valley height (Rz), surface profiles and three-dimensional surface topography of the samples. The sample chemical composition was determined by XPS (Kratos Axis Ultra, Shimadzu, Japan). Sample surface wettability was evaluated using a contact angle measurement system (VSA 2500 XE; AST Products, Billerica, MA, USA).
4.4. Biofilm Dekontaminierung
S. aureus-Kultur wurde aus einer einzelnen Kolonie hergestellt, die in 5 mL tryptische Sojabrühe (TSB) beimpft und 16 h bei 37 °C inkubiert wurde. Ein Milliliter Bakteriensuspension, die durch Zugabe von frischem TSB-Medium auf eine Konzentration von 1 × 105 KBE/mL eingestellt wurde, wurde auf die Oberfläche des TNS gegeben, was nach 24 h Inkubation zur Bildung eines Biofilms führte. Dann wurde die Bakteriensuspension entfernt, und die Proben wurden durch Spülen mit Phosphatpuffer-Salzlösung (PBS) zur Entfernung nicht anhaftender Bakterien für die anschließende Plasmabehandlung vorbereitet. Nach der Plasmabehandlung wurden die Proben in ein steriles Reagenzglas mit 5 mL TSB-Medium überführt und 2 Minuten lang gewirbelt, um den gebildeten Biofilm abzulösen. Die Quantifizierung der in der Lösung enthaltenen Bakterien wurde mit der Plattenzählmethode durchgeführt [58].
4.5. Zellkultur
Die rBMMSCs wurden aus den Oberschenkeln von 8 Wochen alten Sprague-Dawley-Ratten (SHIMIZU Laboratory Supplies Co., Kyoto, Japan) gewonnen. Die Zellen wurden in einem Wachstumsmedium kultiviert, das minimales essentielles Medium (Nacalai Tesque Inc., Tokyo, Japan), 10% fötales Rinderserum (Nacalai Tesque Inc.) und eine antibiotisch-antimykotische gemischte Stammlösung (Nacalai Tesque Inc.) in einem mit 5% CO2 befeuchteten Inkubator bei 37°C enthielt. Das Medium wurde alle 3 Tage gewechselt.
4.6. Zell Morphologie
Nach 24-stündiger Inkubation wurden die Proben mit PBS gewaschen, fixiert durch 20-minütiges Inkubieren mit 4%iger Paraformaldehydlösung, die mit 0 permeabilisiert wurde. 2% (v/v) Triton X-100 für 30 min, mit Blocking One Reagenz (Nacalai Tesque, Kyoto, Japan) für 30 min inkubiert und dann mit Alexa Fluor 488-Phalloidin (Invitrogen/Life Technologies) und DAPI bei 37 °C im Dunkeln für 1 h gefärbt. Ein konfokales Laser-Scanning-Mikroskop (LSM700; Carl Zeiss) wurde zur Auswertung des F-Aktins und der Zellkerne von adhärenten Zellen verwendet. Aus drei repräsentativen Bildern, die pro Oberfläche von drei Proben jeder Gruppe gemessen wurden, wurden insgesamt 30 Zellen nach dem Zufallsprinzip ausgewählt, so der aktuelle Bericht. Und für die Fluoreszenzbildanalyse wurde die Software ImageJ verwendet.
4.7. Zell Adhäsion
Die rBMMSCs wurden in einer anfänglichen Dichte von 4 × 104 Zellen/cm2 auf die Proben gesät und 1, 3, 6 und 24 h anhaften gelassen. Nach der Inkubation bei 37°C wurden die nicht anhaftenden Zellen durch Waschen mit PBS (Nacalai Tesque, Inc.) entfernt und mit 300 μL verdünnten CellTiter-Blue® Reagenz (50 μL CellTiter-Blue® Reagenz verdünnt in 250 μL PBS) kultiviert. Nach einer zusätzlichen 1-stündigen Inkubation wurde die Fluoreszenzintensität mit einem Mikrotiterplatten-Lesegerät (SpectraMax M5; Molecular Devices, Sunnyvale, CA, USA) nach dem Protokoll des Herstellers gemessen.
4.8. Bestimmung der intrazellulären ROS
Die Erzeugung intrazellulärer ROS wurde unter Verwendung der oxidationsempfindlichen Fluoreszenzsonde 2′,7′-Dichlorfluoresceindiacetat (DCFH-DA, Sigma, St. Louis, MO, USA) analysiert. Nach einer Inkubation von 24 h wurden die Zellen mit PBS gewaschen und mit 10 mM DCFH-DA für 30 min bei 37 °C inkubiert. Danach wurden die Zellen zweimal mit PBS gewaschen, mit 50 µL Trypsin (0,25%) abgelöst und mit 50 µL PBS verdünnt. Anschließend wurde die Fluoreszenz bei einer Anregungs-/Emissionswellenlänge von 485/528 nm mit einem Fluoreszenz-Mikroplatten-Lesegerät entsprechend den Herstellerangaben gemessen.
4.9. Aktivität der Alkalischen Phosphatase (ALP)
Um die ALP-Aktivität zu evaluieren, wurden 4 × 104 Zellen auf den Proben ausgesät und in α-MEM kultiviert, das 10% fötales Rinderserum, Antibiotikum-Pilzbekämpfungsmittel, 10 mM Glycerophosphat (Wako Pure Chemical Industries, Osaka, Japan) und 10 nM Dexamethason (Nacalai Tesque) enthält. Das Differenzierungsmedium wurde alle 3 Tage gewechselt. Nach 7 oder 14 Tagen Inkubation wurden die Proben mit PBS gewaschen, und Zellen, die sich an der Probenoberfläche angeheftet hatten, wurden mit 300 μL von 0,2% Triton X-100 aufgelöst. Die ALP-Aktivität wurde mit einem alkalischen Phosphatase-luminometrischen enzymgekoppelten Immunosorbent-Assay (ELISA)-Kit (Sigma-Aldrich) gemäß den Anweisungen des Herstellers bewertet. Zur Bewertung des DNA-Gehalts wurde ein PicoGreen dsDNA-Analysekit (Invitrogen/Life Technologies) verwendet. Die Menge an ALP wurde auf die Menge an DNA in jedem Zelllysat normalisiert.
4.10. Extrazelluläre Matrix-Mineralisierung
Nach 21 oder 28 Tagen Inkubation wurde die Kalziumablagerung in der extrazellulären Matrix nach Auflösung mit 10%iger Ameisensäure gemessen. Der Kalziumgehalt wurde mit einem Kalzium-E-Testkit (Wako Pure Chemical Industrials Ltd.) gemäß den Anweisungen des Herstellers quantifiziert und berechnet.
4.11. Osteogenese-bezogene Genexpression
Die Expression von Genen, die mit der Osteogenese in Zusammenhang stehen, wurde mit einem Echtzeit-TaqMan-RT-PCR-Assay (Life Technologies, Carlsbad, CA, USA) untersucht. Die Gesamt-RNA wurde mit einem RNeasy Mini-Kit (Qiagen, Venlo, Niederlande) extrahiert, und 10-μL Aliquots jeder RNA-Probe wurden mit einem Prime Script RT-Reagenzienkit (TaKaRa Bio, Shiga, Japan) in cDNA rücktranskribiert. Die mRNA-Gehalte der mit der Osteogenese verbundenen Gene für das knochenmorphogenetische Protein 2 (Bmp 2) und das knochen-gamma-carboxyglutaminsäurehaltige Protein (OCN) wurden mit einem Step One TM Plus RT-PCR-System (Life Technologies) untersucht. Die relativen Genexpressionsniveaus in jeder Gruppe wurden auf das Niveau des Glyceraldehyd-3-Phosphat-Dehydrogenase (GAPDH)-Haushaltsgens normalisiert.
4.12. Tierversuch und chirurgische Verfahren
Der Tierversuch wurde nach den ethischen Grundsätzen der National Animal Care Guidelines durchgeführt und von der Medizinischen Ethikkommission der Osaka Dental University, Japan, genehmigt (Genehmigungsnummer 19-06002, 16. August 2019). In dieser Studie wurden acht Wochen alte männliche Sprague-Dawley-Ratten (Shimizu Laboratory Supplies Co., Kyoto, Japan) mit einem Gewicht von 180-200 g verwendet. Die Ratten wurden nach dem Zufallsprinzip in zwei Gruppen mit jeweils acht Ratten in jeder Gruppe eingeteilt. Die in dieser Studie verwendeten chirurgischen Verfahren wurden zuvor beschrieben [59]. Nach Vollnarkose und chirurgischer Reinigung wurde ein 10-mm-Längsschnitt entlang der medialen Seite des Kniegelenks des rechten Hinterbeins gemacht. Die Patella und der Streckmechanismus wurden dann disloziert, um den distalen Femur freizulegen. In die interkondyläre Kerbe wurde ein 1,2-mm-Loch mit einem Zahnbohrer mit sterilisierter Kochsalzlösungsspülung gebohrt. In die vorbereiteten Kanäle wurden Schrauben implantiert, das Kniegelenk wurde wiederhergestellt und die Inzision genäht. Gentamicin (1 mg/kg) und Buprenorphin (0,05 mg/kg) wurden nach der Operation 3 Tage lang injiziert, um postoperative Infektionen zu verhindern und die postoperativen Schmerzen zu lindern.
4.13. Sequentielle Fluoreszenzmarkierung und Mikrocomputertomographie
Die polychrome sequentielle Markierung des Knochens durch intraperitoneale Injektion von Fluoreszenzfarbstoffen wurde eingesetzt, um den Prozess und die Eigenschaften der Knochenneubildung und -mineralisierung nach der Implantation gemäß dem folgenden Zeitplan zu bestimmen: Ratten wurden 1 Woche nach der Implantation 25 mg/kg Oxytetracyclinhydrochlorid (Sigma-Aldrich, USA), 4 Wochen nach der Implantation 30 mg/kg Alizarinrot S (011-01192, Wako, JP) und 8 Wochen nach der Implantation 20 mg/kg Calcein (340-00433, Wako, Japan) injiziert. Die Ratten wurden dann nach 8 Wochen betäubt und eingeschläfert, und die rechten Oberschenkelknochen einschließlich der Implantate wurden unmittelbar nach der Dissektion in eine Kochsalzlösung gelegt und mit einem SMX-130CT Mikrocomputertomographen (Mikro-CT) (Shimadzu) gescannt, der bei 90kV und 40 μA mit einem Kupferfilter betrieben wurde. Dreidimensionale Rekonstruktionsmodelle wurden mit morphometrischer Software (TRI/3D-BON; Ratoc System Engineering, Tokio, Japan) erstellt. Der interessierende Bereich wurde als 2 mm unterhalb des höchsten Punktes der Wachstumsplatte definiert und erstreckte sich 500 μm um jedes Implantat. Zur Beurteilung der Knochenregeneration wurden die Knochenvolumenfraktion (BV/TV), die mittlere Trabekelzahl (Tb.N), die mittlere Trabekeldicke (Tb.Th) und die mittlere Trabekelseparation (Tb.Sp) quantifiziert.
4.14. Histologie von sequenziell beschrifteten Abschnitten
Nach dem Mikro-CT-Scan wurden die nach 8 Wochen entnommenen implantierten Oberschenkelknochen mit der Villanueva-Methode gefärbt, um die Knochenbildung zu beurteilen. Alle histomorphometrischen und Fluoreszenz-Charakteristika der Schnitte wurden mit einem digitalen Kaltlichtmikroskop BZ-9000 (Keyence Co., Osaka, Japan) bzw. einem Laser-Scanning-Mikroskop (Carl Zeiss, Oberkochen, Deutschland) analysiert. Die Anregungs- und Emissionswellenlängen betrugen 351/460 nm für Oxytetracyclinhydrochlorid (blau), 543/617 nm für Alizarinrot S (rot) bzw. 488 nm/517 nm für Calcein (grün). Knochenfläche, BIC und markierte Knochenfläche wurden unter Verwendung der ImageJ-Software in einem 200-fachen Feld um das Implantat herum beurteilt.
4.15. Statistische Analyse
Alle Daten wurden als Mittelwert ± Standardabweichung ausgedrückt. Jedes Experiment wurde dreimal wiederholt, und alle Ergebnisse wurden in SPSS 26.0 durch den Student’s t-Test verglichen; P< 0,05 wurde als statistisch signifikant angesehen.
5. Schlussfolgerung
Die Plasmabehandlung von Titanoberflächen mit Nanonetzwerk veränderte effektiv die chemische Zusammensetzung der Probenoberfläche, was die Hydrophilie des Implantats weiter verbesserte und die Zellanhaftung und -ausdehnung erleichterte; die Knochenneubildung wurde deutlich beschleunigt und die Osseointegration in der frühen Phase der Implantation verbessert. Darüber hinaus wurde durch die Plasmabehandlung die Implantatoberfläche effizient dekontaminiert, wobei die nanoskalige Morphologie der TNS-Oberfläche erhalten blieb und gleichzeitig eine für die Osteogenese vorteilhafte Oberfläche erzeugt wurde, die als neuartiger Ansatz für die Sofortbehandlung vor der Implantation oder als Therapiemethode bei Periimplantitis eingesetzt werden könnte. Darüber hinaus hat die Aufklärung der Wirkung auf Zelladhäsion, Differenzierung und Dekontamination durch Plasmabehandlung sinnvolle Hinweise für die zukünftige Forschung und die Entwicklung plasmabasierter therapeutischer Strategien geliefert.
Autoren-Beiträge
A.A., T.S. und S.K. konzipierten und gestalteten die Experimente; Y.Z. führte die Experimente durch; S.K., H.N. und Y.Z. analysierten die Daten; J.O. steuerte Reagenzien/Materialien/Analysewerkzeuge bei; Y.Z. schrieb die Arbeit. Alle Autoren haben die veröffentlichte Version des Manuskripts gelesen und zugestimmt.
Finanzierung
Diese Studie wurde durch einen Zuschuss der Japanischen Gesellschaft zur Förderung der Wissenschaften (19K19146 und 18K09713) und des Osaka Dental University Research Funds (20-08) unterstützt.
Anmerkungen
Wir danken Tohru Sekino und Hisataka Nishida von der Universität Osaka für die Vorbereitung des TNS und die Bereitstellung hilfreicher Vorschläge. Wir danken Akinori Agariguchi von der Zahnärztlichen Universität Osaka für den nützlichen Rat. Wir danken auch Yasuyuki Kobayashi vom Osaka Research Institute of Industrial Science and Technology Morinomiya Center für hilfreiche Vorschläge. Wir danken auch den Mitgliedern der Abteilung für herausnehmbare Prothodontie und Okklusion und der Abteilung für Parodontologie für ihren Rat und ihre Unterstützung.
Interessenskonflikt
Die Autoren erklären, dass kein Interessenkonflikt vorliegt.
Referenzen
- Adell, R.; Eriksson, B.; Lekholm, U.; Brånemark, P.I.; Jemt, T. Long-term follow-up study of osseointegrated implants in the treatment of totally edentulous jaws. Int. J. Oral Maxillofac. Implant. 1990, 5, 347–359.
- Albrektsson, T.; Brånemark, P.I.; Hansson, H.A.; Lindström, J. Osseointegrated titanium implants: Requirements for ensuring a long-lasting, direct bone-to-implant anchorage in man. Acta Orthop. 1981, 52, 155–170.
- Van Steenberghe, D.; Jacobs, R.; DeSnyder, M.; Maffei, G.; Quirynen, M. The relative impact of local and endogenous patient-related factors on implant failure up to the abutment stage. Clin. Oral Implant. Res. 2002, 13, 617–622.
- Pierre, S.; Dufour, T.; Tenenbaum, H. Long-term implant survival and success: A 10–16-year follow-up of non-submerged dental implants. Clin. Oral Implant. Res. 2010, 21, 772–777.
- Chrcanovic, B.R.; Kisch, J.; Albrektsson, T.; Wennerberg, A. A retrospective study on clinical and radiological outcomes of oral implants in patients followed up for a minimum of 20 years. Clin. Implant. Dent. Relat. Res. 2018, 20, 199–207.
- Roos-Jansåker, A.M.; Renvert, S.; Egelberg, J. Treatment of peri-implant infections: A literature review. J. Clin. Periodontol. 2003, 30, 467–485.
- Lang, N.P.; Salvi, G.E.; Huynh-Ba, G.; Ivanovski, S.; Donos, N.; Bosshardt, D.D. Early osseointegration to hydrophilic and hydrophobic implant surfaces in humans. Clin. Oral Implant. Res. 2011, 22, 349–356. ]
- Scotchford, C.A.; Gilmore, C.P.; Cooper, E.; Leggett, G.J.; Downes, S. Protein adsorption and human osteoblast-like cell attachment and growth on alkylthiol on gold self-assembled monolayers. J. Biomed. Mater. Res. 2002, 59, 84–99.
- Wang, X.X.; Hayakawa, S.; Tsuru, K.; Osaka, A. Bioactive titania gel layers formed by chemical treatment of Ti substrate with a H2O2/HCl solution. Biomaterials 2002, 23, 1353–1357.
- Nanci, A.; Wuest, J.D.; Peru, L.; Brunet, P.; Sharma, V.; Zalzal, S.; McKee, M.D. Chemical modification of titanium surfaces for covalent attachment of biological molecules. J. Biomed. Mater. Res. 1998, 40, 324–335.
- Arias, J.L.; Mayor, M.B.; Pou, J.; Leng, Y.; León, B.; Pérez-Amor, M. Micro- and nano-testing of calcium phosphate coatings produced by pulsed laser deposition. Biomaterials 2003, 24, 3403–3408.
- Gambardella, A.; Bianchi, M.; Kaciulis, S.; Mezzi, A.; Brucale, M.; Cavallini, M.; Herrmannsdoerfer, T.; Chanda, G.; Uhlarz, M.; Cellini, A.; et al. Magnetic hydroxyapatite coatings as a new tool in medicine: A scanning probe investigation. Mater. Sci. Eng. C 2016, 62, 444–449.
- Le Guéhennec, L.; Soueidan, A.; Layrolle, P.; Amouriq, Y. Surface treatments of titanium dental implants for rapid osseointegration. Dent. Mater. 2007, 23, 844–854.
- Hanawa, T. A comprehensive review of techniques for biofunctionalization of titanium. J. Periodontal. Implant. Sci. 2011, 41, 263–272.
- Souza, J.C.M.; Sordi, M.B.; Kanazawa, M.; Ravindran, S.; Henriques, B.; Silva, F.S.; Aparicio, C.; Cooper, L.F. Nano-scale modification of titanium implant surfaces to enhance osseointegration. Acta Biomater. 2019, 94, 112–131.
- Komasa, S.; Taguchi, Y.; Nishida, H.; Tanaka, M.; Kawazoe, T. Bioactivity of nanostructure on titanium surface modified by chemical processing at room temperature. J. Prosthodont. Res. 2012, 56, 170–177.
- Xing, H.; Komasa, S.; Taguchi, Y.; Sekino, T.; Okazaki, J. Osteogenic activity of titanium surfaces with nanonetwork structures. Int. J. Nanomed. 2014, 9, 1741.
- Hu, X.; Neoh, K.G.; Zhang, J.; Kang, E.T. Bacterial and osteoblast behavior on titanium, cobalt-chromium alloy and stainless steel treated with alkali and heat: A comparative study for potential orthopedic applications. J Colloid Interface Sci. 2014, 417, 410–419.
- Koulik, P.; Begounov, S.; Goloviatinskii, S. Atmospheric plasma sterilization and deodorization of dielectric surfaces. Plasma Chem. Plasma Process. 1999, 19, 311–326.
- Fridman, A.; Chirokov, A.; Gutsol, A. Non-thermal atmospheric pressure discharges. J. Phys. D Appl. Phys. 2005, 38, R1.
- Chang, J.S.; Lawless, P.A.; Yamamoto, T. Corona Discharge Processes. IEEE Trans. Plasma Sci. 1991, 19, 1152–1166.
- Benstaali, B.; Boubert, P.; Cheron, B.G.; Addou, A.; Brisset, J.L. Density and Rotational Temperature Measurements of the OH and NO Radicals Produced by a Gliding Arc in Humid Air. Plasma Chem. Plasma Process. 2002, 22, 553–571.
- Moreau, M.; Orange, N.; Feuilloley, M.G.J. Non-thermal plasma technologies: New tools for bio-decontamination. Biotechnol. Adv. 2008, 26, 610–617.
- Park, J.H.; Olivares-Navarrete, R.; Baier, R.E.; Meyer, A.E.; Tannenbaum, R.; Boyan, B.D.; Schwartz, Z. Effect of cleaning and sterilization on titanium implant surface properties and cellular response. Acta Biomater. 2012, 8, 1966–1975.
- Modic, M.; Kovač, J.; Nicholls, J.R.; Kos, Š.; Serša, G.; Cvelbar, U.; Walsh, J. Targeted plasma functionalization of titanium inhibits polymicrobial biofilm recolonization and stimulates cell function. Appl. Surf. Sci. 2019, 487, 1176–1188.
- Lee, J.-H.; Jeong, W.-S.; Seo, S.-J.; Kim, H.-W.; Kim, K.-N.; Choi, E.H.; Kim, K.-M. Non-thermal atmospheric pressure plasma functionalized dental implant for enhancement of bacterial resistance and osseointegration. Dent. Mater. 2017, 33, 257–270.
- Duske, K.; Koban, I.; Kindel, E.; Schröder, K.; Nebe, B.; Holtfreter, B.; Jablonowski, L.; Weltmann, K.D.; Kocher, T. Atmospheric plasma enhances wettability and cell spreading on dental implant metals. J. Clin. Periodontol. 2012, 39, 400–407.
- Henningsen, A.; Smeets, R.; Heuberger, R.; Jung, O.T.; Hanken, H.; Heiland, M.; Cacaci, C.; Precht, C. Changes in surface characteristics of titanium and zirconia after surface treatment with ultraviolet light or non-thermal plasma. Eur. J. Oral Sci. 2018, 126, 126–134.
- Duske, K.; Jablonowski, L.; Koban, I.; Matthes, R.; Holtfreter, B.; Sckell, A.; Nebe, J.B.; Von Woedtke, T.; Weltmann, K.-D.; Kocher, T. Cold atmospheric plasma in combination with mechanical treatment improves osteoblast growth on biofilm covered titanium discs. Biomaterials 2015, 52, 327–334.
- Zhang, H.; Komasa, S.; Mashimo, C.; Sekino, T.; Okazaki, J. Effect of ultraviolet treatment on bacterial attachment and osteogenic activity to alkali-treated titanium with nanonetwork structures. Int. J. Nanomed. 2017, 12, 4633.
- Zeng, Y.; Yang, Y.; Chen, L.; Yin, D.; Zhang, H.; Tashiro, Y.; Inui, S.; Kusumoto, T.; Nishizaki, H.; Sekino, T.; et al. Optimized surface characteristics and enhanced in vivo osseointegration of alkali-treated titanium with nanonetwork structures. Int. J. Mol. Sci. 2019, 20, 1127.
- Moulder, J.F.; Stickle, W.F.; Sobol, P.E.; Bomben, K.D. Handbook of X-Ray Photoelectron Spectroscopy: A Reference Book of Standard Spectra for Identification and Interpretation of XPS Data; Physical Electronics, Inc.: Eden Prairie, MN, USA, 1995; 261 p.
- Rosseler, O.; Sleiman, M.; Montesinos, N.; Shavorskiy, A.; Keller, V.; Keller, N.; Litter, M.; Bluhm, H.; Salmeron, M.; Destaillats, H. Chemistry of NOx on TiO2 surfaces studied by ambient pressure XPS: Products, effect of UV irradiation, water, and coadsorbed K+. J. Phys. Chem. Lett. 2013, 4, 536–541.
- Dalton, J.S.; Janes, P.A.; Jones, N.G.; Nicholson, J.A.; Hallam, K.R.; Allen, G.C. Photocatalytic oxidation of NOx gases using TiO2: A surface spectroscopic approach. Environ. Pollut. 2002, 120, 415–422.
- Farfan-Arribas, E.; Madix, R.J. Characterization of the acid-base properties of the TiO2(110) surface by adsorption of amines. J. Phys. Chem. B 2003, 107, 3225–3233.
- Shimizu, T.; Sakiyama, Y.; Graves, D.B.; Zimmermann, J.L.; Morfill, G.E. The dynamics of ozone generation and mode transition in air surface micro-discharge plasma at atmospheric pressure. New J. Phys. 2012, 14, 103028.
- Horbett, T.A.; Waldburger, J.J.; Ratner, B.D.; Hoffman, A.S. Cell adhesion to a series of hydrophili–hydrophobic copolymers studies with a spinning disc apparatus. J. Biomed. Mater. Res. 1988, 22, 383–404.
- Hetrick, E.M.; Schoenfisch, M.H. Reducing implant-related infections: Active release strategies. Chem. Soc. Rev. 2006, 35, 780–789.
- Nablo, B.J.; Prichard, H.L.; Butler, R.D.; Klitzman, B.; Schoenfisch, M.H. Inhibition of implant-associated infections via nitric oxide release. Biomaterials 2005, 26, 6984–6990.
- Zhao, Y.; Jamesh, M.I.; Li, W.K.; Wu, G.; Wang, C.; Zheng, Y.; Yeung, K.W.K.; Chu, P.K. Enhanced antimicrobial properties, cytocompatibility, and corrosion resistance of plasma-modified biodegradable magnesium alloys. Acta Biomater. 2014, 10, 544–556.
- Park, J.Y.; Park, S.; Choe, W.; Yong, H.I.; Jo, C.; Kim, K. Plasma-Functionalized Solution: A Potent Antimicrobial Agent for Biomedical Applications from Antibacterial Therapeutics to Biomaterial Surface Engineering. ACS Appl. Mater. Interfaces 2017, 9, 43470–43477.
- Canullo, L.; Genova, T.; Wang, H.-L.; Carossa, S.; Mussano, F. Plasma of Argon Increases Cell Attachment and Bacterial Decontamination on Different Implant Surfaces. Int. J. Oral Maxillofac. Implant. 2017, 32, 1315–1323.
- Lunov, O.; Zablotskii, V.; Churpita, O.; Jäger, A.; Polívka, L.; Syková, E.; Dejneka, A.; Kubinová, Š. The interplay between biological and physical scenarios of bacterial death induced by non-thermal plasma. Biomaterials 2016, 82, 71–83.
- Flynn, P.B.; Higginbotham, S.; Alshraiedeh, N.H.; Gorman, S.P.; Graham, W.G.; Gilmore, B.F. Bactericidal efficacy of atmospheric pressure non-thermal plasma (APNTP) against the ESKAPE pathogens. Int. J. Antimicrob. Agents 2015, 46, 101–107.
- Canullo, L.; Genova, T.; Tallarico, M.; Gautier, G.; Mussano, F.; Botticelli, D. Plasma of argon affects the earliest biological response of different implant surfaces: An in vitro comparative study. J. Dent. Res. 2016, 95, 566–573.
- Canullo, L.; Genova, T.; Mandracci, P.; Mussano, F.; Abundo, R.; Fiorellini, J. Morphometric Changes Induced by Cold Argon Plasma Treatment on Osteoblasts Grown on Different Dental Implant Surfaces. Int. J. Periodontics Restor. Dent. 2017, 37, 541–548.
- Martin, K.R.; Barrett, J.C. Reactive oxygen species as double-edged swords in cellular processes: Low-dose cell signaling versus high-dose toxicity. Hum. Exp. Toxicol. 2002, 21, 71–75.
- Finkel, T. Oxidant signals and oxidative stress. Curr. Opin. Cell Boil. 2003, 15, 247–254.
- Ghaffari, S. Oxidative stress in the regulation of normal and neoplastic hematopoiesis. Antioxidants Redox Signal. 2008, 10, 1923–1940.
- Case, J.; Ingram, D.A.; Haneline, L.S. Oxidative stress impairs endothelial progenitor cell function. Antioxidants Redox Signal. 2008, 10, 1895–1907.
- Kobayashi, C.I.; Suda, T. Regulation of reactive oxygen species in stem cells and cancer stem cells. J. Cell. Physiol. 2011, 227, 421–430.
- Pervaiz, S.; Taneja, R.; Ghaffari, S. Oxidative stress regulation of stem and progenitor cells. Antioxidants Redox Signal. 2009, 11, 2777–2789.
- Shi, X.; Zhang, Y.; Zheng, J.; Pan, J. Reactive oxygen species in cancer stem cells. Antioxidants Redox Signal. 2012, 16, 1215–1228.
- Wang, K.; Zhang, T.; Dong, Q.; Nice, E.C.; Huang, C.; Wei, Y. Redox homeostasis: The linchpin in stem cell self-renewal and differentiation. Cell Death Dis. 2013, 4, e537.
- Ueno, T.; Ikeda, T.; Tsukimura, N.; Ishijima, M.; Minamikawa, H.; Sugita, Y.; Yamada, M.; Wakabayashi, N.; Ogawa, T. Novel antioxidant capability of titanium induced by UV light treatment. Biomaterials 2016, 108, 177–186.
- Gomez-Puerto, M.C.; Verhagen, L.P.; Braat, A.K.; Lam, E.W.-F.; Coffer, P.J.; Lorenowicz, M.J. Activation of autophagy by FOXO3 regulates redox homeostasis during osteogenic differentiation. Autophagy 2016, 12, 1804–1816.
- Ambrogini, E.; Almeida, M.; Martin-Millan, M.; Paik, J.-H.; Depinho, R.A.; Han, L.; Goellner, J.; Weinstein, R.S.; Jilka, R.L.; O’Brien, C.A.; et al. FoxO-Mediated Defense against Oxidative Stress in Osteoblasts Is Indispensable for Skeletal Homeostasis in Mice. Cell Metab. 2010, 11, 136–146.
- Wand, M.E.; Bock, L.J.; Turton, J.F.; Nugent, P.G.; Mark Sutton, J. Acinetobacter baumannii virulence is enhanced in Galleria mellonella following biofilm adaptation. J. Med. Microbiol. 2012, 61, 470–477.
- Su, Y.; Komasa, S.; Li, P.; Nishizaki, M.; Chen, L.; Terada, C.; Yoshimine, S.; Nishizaki, H.; Okazaki, J. Synergistic effect of nanotopography and bioactive ions on peri-implant bone response. Int. J. Nanomed. 2017, 12, 925–934.
© 2020 by the authors. Licensee MDPI, Basel, Switzerland. This article is an open access article distributed under the terms and conditions of the Creative Commons Attribution (CC BY) license (http://creativecommons.org/licenses/by/4.0/).




